AMSTERDAM - Európska agentúra pre lieky (EMA) v piatok zamietla žiadosť o uvedenie nového lieku na Alzheimerovu chorobu na trh. Riziká vedľajších účinkov lieku vrátane možného krvácania do mozgu vraj prevažujú nad jeho prínosmi.
"Výbor EMA pre lieky na humánne použitie (CHMP) odporučil neudeliť registráciu lieku Leqembi, ktorý je určený na liečbu Alzheimerovej choroby," oznámila EMA.Liek Leqembi používa účinnú látku nazývanú lecanemab na liečbu dospelých s miernymi problémami s pamäťou a kognitívnymi funkciami, ktoré sú dôsledkom raných štádií bežného typu demencie, vysvetľuje AFP.Podľa CHMP však "pozorovaný účinok lieku Leqembi na oddialenie poklesu kognitívnych funkcií nevyváži riziko závažných nežiaducich účinkov spojených s liekom".
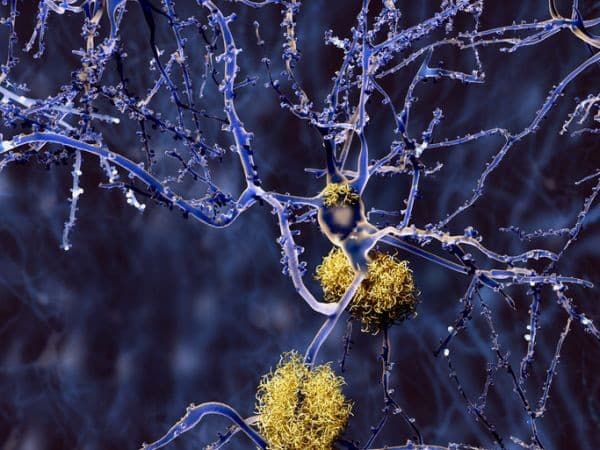
"Najdôležitejším bezpečnostným problémom pri lieku Leqembi je častý výskyt zobrazovaných abnormalít súvisiacich s amyloidom (ARIA), vedľajším účinkom, ktorý možno vidieť pri zobrazovaní mozgu a ktorý zahŕňa opuch a možné krvácanie do mozgu," uviedla EMA.Leqembi je monoklonálna protilátka, typ proteínu, ktorý sa viaže na konkrétnu látku v mozgu a môže oddialiť zhoršenie ochorenia.
Americký Úrad pre kontrolu potravín a liečiv (FDA) minulý rok dal súhlas na užívanie lieku Laqembi a tiež ďalšieho lieku Aduhelm. Oba lieky boli podľa AFP schválené prostredníctvom zrýchleného procesu, ktorý FDA uplatňuje na lieky určené na liečbu závažných ochorení, pri ktorých existuje nenaplnená medicínska potreba.Podľa webovej stránky Alzheimer Europe žije v Európskej únii približne osem miliónov ľudí s demenciou, pričom viac ako polovica z nich trpí Alzheimerovou chorobou. Očakáva sa, že do roku 2050 sa ich počet zdvojnásobí, píše Reuters.